Madhyamik 2026 Mathematics Question Paper Solution
মাধ্যামিক ২০২৬ পরীক্ষার্থীদের জন্য ভৌতবিজ্ঞান প্রশ্নপত্রের সম্পূর্ণ সমাধান এখানে দেওয়া হলো। এই পোস্টে বহুবিকল্পধর্মী প্রশ্ন, সংক্ষিপ্ত উত্তর, গাণিতিক সমস্যা ও ব্যাখ্যামূলক প্রশ্নের ধাপে ধাপে সমাধান সহজ বাংলা ভাষায় উপস্থাপন করা হয়েছে। পরীক্ষার জন্য গুরুত্বপূর্ণ অধ্যায়ভিত্তিক আলোচনা ও সঠিক উত্তর লেখার কৌশলও এখানে দেওয়া আছে
১.বহু বিকল্প ভিত্তিক প্রশ্ন। প্রতিটি প্রশ্নের নীচে চারটি করে বিকল্প উত্তর দেওয়া আছে যেটি ঠিক সেটি লেখো:
১.১ নীচের কোন্ গ্যাসটি ওজোন স্তরে ওজোন ক্ষয়ে সহায়তা করে না?
সংক্ষিপ্ত ব্যাখ্যা: CFC এবং নাইট্রোজেন অক্সাইড (NO, NO_2) ওজোন স্তরে রাসায়নিক বিক্রিয়ার মাধ্যমে ওজোন ক্ষয় ঘটায়। কিন্তু CO_2 সরাসরি ওজোন স্তরের ক্ষয়ে সহায়তা করে না।
১.২ STP-তে 11.2 L NH_3 গ্যাসের ভর হল — [N = 14, H = 1]
সংক্ষিপ্ত ব্যাখ্যা: STP-তে 22.4 L গ্যাস = 1 মোল।
অতএব 11.2 L = 0.5 মোল।
NH_3-এর মোলার ভর = 14 + 3 \times 1 = 17 g।
সুতরাং ভর = 0.5 \times 17 = 8.5 g
১.৩ নীচের রাসায়নিক সমীকরণ অনুযায়ী
CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O,
5 মোল CH_4 সম্পূর্ণ দহন করতে STP-তে কত আয়তনের O_2 লাগবে?
সংক্ষিপ্ত ব্যাখ্যা: সমীকরণ অনুযায়ী 1 মোল CH_4 দহনে 2 মোল O_2 লাগে।
অতএব 5 মোল CH_4 এর জন্য প্রয়োজন = 5 \times 2 = 10 মোল O_2।
STP-তে 1 মোল গ্যাসের আয়তন = 22.4 L
সুতরাং প্রয়োজনীয় আয়তন = 10 \times 22.4 = 224 L
১.৪ তাপ পরিবাহিতার SI একক হল —
সংক্ষিপ্ত ব্যাখ্যা: তাপ পরিবাহিতা (Thermal conductivity)-র SI একক হল
W\,m^{-1}\,K^{-1} অর্থাৎ
\text{ওয়াট.মিটার}^{-1}\text{.কেলভিন}^{-1}।
১.৫ মানুষের সুস্থ চোখের ক্ষেত্রে দূরবিন্দুর অবস্থান হল —
সংক্ষিপ্ত ব্যাখ্যা: সুস্থ চোখের ক্ষেত্রে দূরবিন্দু (Far point) অসীম দূরত্বে অবস্থিত। অর্থাৎ সুস্থ চোখ অসীম দূরের বস্তু স্পষ্টভাবে দেখতে পারে।
১.৬ যখন কোন আলোকরশ্মি কাচের ফলকে বা সমতল উপরিভাগে আপতিত হয়, তখন প্রতিফলনের মান হবে —
সংক্ষিপ্ত ব্যাখ্যা: যদি আলোকরশ্মি সমতল পৃষ্ঠের উপর লম্বভাবে (অর্থাৎ লম্বের সাথে সমাপতিত হয়ে) আপতিত হয়, তবে আপতন কোণ 0° হয়। প্রতিফলনের সূত্র অনুযায়ী প্রতিফলন কোণ = আপতন কোণ। তাই প্রতিফলনের মানও 0° হবে।
১.৭ কত সংখ্যক ইলেকট্রনের মোট আধান 1 C ?
সংক্ষিপ্ত ব্যাখ্যা: 1 ইলেকট্রনের আধান = 1.6 \times 10^{-19} C।
অতএব 1 C আধান পেতে প্রয়োজন ইলেকট্রনের সংখ্যা = \frac{1}{1.6 \times 10^{-19}} = 6.25 \times 10^{18}।
১.৮ তাপমাত্রা বৃদ্ধিতে রোধ হ্রাস পায় —
সংক্ষিপ্ত ব্যাখ্যা: ধাতুর ক্ষেত্রে তাপমাত্রা বৃদ্ধি পেলে রোধ বৃদ্ধি পায়। কিন্তু অর্ধপরিবাহীর (যেমন সিলিকন) ক্ষেত্রে তাপমাত্রা বৃদ্ধি পেলে রোধ হ্রাস পায়।
১.৯ একটি ইলেকট্রনের ভর m হলে, একটি β-কণার ভর হল —
সংক্ষিপ্ত ব্যাখ্যা: β-কণা আসলে উচ্চগতিসম্পন্ন ইলেকট্রন। তাই একটি β-কণার ভর ইলেকট্রনের ভরের সমান, অর্থাৎ m
১.১০ মৌলের পারমাণবিক সংখ্যা 19 হলে, আধুনিক পর্যায়সারণিতে মৌলটি কোন শ্রেণিতে অবস্থান করবে?
সংক্ষিপ্ত ব্যাখ্যা: পারমাণবিক সংখ্যা 19 হলে মৌলটি হল পটাশিয়াম (K)। এর ইলেকট্রন বিন্যাস 2,8,8,1। বহিঃস্তরে 1টি ইলেকট্রন থাকায় এটি আধুনিক পর্যায়সারণির 1 নম্বর শ্রেণিতে অবস্থান করে।
১.১১ অ্যামোনিয়া শুষ্ককরণের জন্য ব্যবহৃত হয় —
সংক্ষিপ্ত ব্যাখ্যা: অ্যামোনিয়া (NH_3) একটি ক্ষারীয় গ্যাস। CaCl_2, H_2SO_4 ও P_2O_5 এর সঙ্গে এটি বিক্রিয়া করতে পারে। কিন্তু CaO (কুইকলাইম) অ্যামোনিয়ার সঙ্গে বিক্রিয়া না করে শুধু জলীয় বাষ্প শোষণ করে, তাই এটি অ্যামোনিয়া শুষ্ককরণের জন্য ব্যবহৃত হয়।
১.১২ নীচের কোন মৌলটি ডুরালুমিনে উপস্থিত থাকে না ?
সংক্ষিপ্ত ব্যাখ্যা: ডুরালুমিন হল অ্যালুমিনিয়ামের সংকর ধাতু, যাতে প্রধানত Al, Cu, Mg এবং অল্প পরিমাণ Mn থাকে। এতে Zn থাকে না।
১.১৩ কপার সালফেটের জলীয় দ্রবে অতিরিক্ত পরিমাণ জলীয় অ্যামোনিয়া যোগ করলে উৎপন্ন দ্রবের রং কী হবে ?
সংক্ষিপ্ত ব্যাখ্যা: কপার সালফেটের দ্রবে অতিরিক্ত অ্যামোনিয়া যোগ করলে [Cu(NH_3)_4]^{2+} জটিল আয়ন গঠিত হয়, যার রং গাঢ় নীল।
১.১৪ নীচের কোনটির তড়িৎ পরিবহন ক্ষমতা সর্বাধিক ?
সংক্ষিপ্ত ব্যাখ্যা: তড়িৎ পরিবাহিতা আয়নের উপস্থিতির উপর নির্ভর করে। বিশুদ্ধ জল ও চিনির দ্রবণে প্রায় আয়ন থাকে না। অ্যাসিটিক অ্যাসিড দুর্বল তড়িৎ বিশ্লেষ্য। কিন্তু তরল হাইড্রোজেন ক্লোরাইড শক্ত তড়িৎ বিশ্লেষ্য, তাই এর তড়িৎ পরিবহন ক্ষমতা সর্বাধিক।
১.১৫ মিথেন অণুতে H - C - H বন্ধন কোণের মান হল —
সংক্ষিপ্ত ব্যাখ্যা: মিথেন (CH_4) অণুর গঠন চতুর্মুখী (tetrahedral)। চতুর্মুখী গঠনে বন্ধন কোণ প্রায় 109^\circ 28′।
২. নিম্নলিখিত প্রশ্নগুলির উত্তর দাও (বিকল্প প্রশ্নগুলি লক্ষণীয়):
২.১ বায়োগ্যাসের মূল উপাদানটির নাম লেখো।
অথবা. আমাদের শ্বাসক্রিয়ার সঙ্গে জড়িত এমন একটি গ্যাসের নাম লেখো যেটির পরিমাণ বায়ুমণ্ডলে বাড়লে বিশ্বউষ্ণায়ন ঘটে।
২.২ প্রাকৃতিক গ্যাসের তাপমান 50 KJg⁻¹ বলতে কী বোঝায় ?
২.৩ নীচের বিবৃতিটি সত্য না মিথ্যা লেখো : একই উষ্ণতা ও চাপে সমআয়তন সকল গ্যাসে সমান সংখ্যক অণু থাকে।
২.৪ আদর্শ গ্যাস ধ্রুবকের SI এককটি লেখো।
২.৫ নীচের বিবৃতিটি সত্য না মিথ্যা লেখো : কোনো তরলের প্রকৃত প্রসারণ ওই তরলটি যে পাত্রে রাখা হয় তার প্রসারণের উপর নির্ভর করে।
অথবা. কোন পরিবাহীর দৈর্ঘ্য এবং প্রস্থচ্ছেদের ক্ষেত্রফল অপরিবর্তিত থাকলে ওই পরিবাহীর তড়িৎ রোধ এবং তাপ পরিবাহিতার মধ্যে সম্পর্ক কী ?
২.৬ কোন বর্ণের আলোর বিক্ষেপণ সর্বনিম্ন ?
২.৭ একটি প্রাকৃতিক বর্ণালির উদাহরণ দাও।
২.৮ এমন একটি যন্ত্রের নাম লেখো যেখানে তড়িৎশক্তি যান্ত্রিক শক্তিতে রূপান্তরিত হয়।
২.৯ 1 C তড়িৎ আধানকে 1 V বিভব প্রভেদের বিরুদ্ধে নিতে কত পরিমাণ কাজ করতে হবে ?
২.১০ ধনাত্মক আধানযুক্ত তেজস্ক্রিয় কণাটির নাম লেখো।
অথবা. পারমাণবিক চুল্লিতে কোন ধরনের নিউক্লীয় বিক্রিয়ার সাহায্যে শক্তি উৎপন্ন হয় ?
২.১১ বাম স্তম্ভের সঙ্গে ডান স্তম্ভের সামঞ্জস্য বিধান করঃ
| বাম স্তম্ভ | ডান স্তম্ভ |
|---|---|
| ২.১.১ সর্বাধিক তড়িৎ ঋণাত্মক মৌল | (c) F |
| ২.১.২ রেড হেমাটাইট থেকে নিষ্কাশিত হয় | (d) Fe |
| ২.১.৩ যে মৌলের আয়নায় লোহার মরিচা গঠনে অনিবার্য করে | (b) Cl |
| ২.১.৪ ধাতু সংকর গঠনে যে ধাতুর শতাংশ পরিমাণ অন্য ধাতুর শতাংশ পরিমাণ থেকে বেশি | (a) Cu |
২.১২ নিচের যৌগগুলির মধ্যে কোনটি সমযোজী যৌগ? পটাসিয়াম ক্লোরাইড, সোডিয়াম ব্রোমাইড, কার্বন টেট্রাক্লোরাইড।
২.১৩ গোল্ড প্লেটিং এর জন্য ব্যবহৃত তড়িৎবিয়োজনের নাম লেখো।
অথবা — কোনো তড়িৎবিশ্লেষ্য পদার্থের জলীয় দ্রবণ তড়িৎবিশ্লেষণের সময় ওই দ্রবণে কিসের মাধ্যমে তড়িৎ পরিবহন ঘটে?
২.১৪ তড়িৎবিশ্লেষণে পরিবর্তী প্রবাহ ব্যবহার করা যায় না কেন?
২.১৫ লেড নাইট্রেটের দ্রবণে H₂S গ্যাস চালনা করলে যে কালো বর্ণের অধঃক্ষেপ সৃষ্টি হয় তার সংকেত লেখো।
অথবা. শূন্যস্থান পূরণ করো :
2 NH₃ + CO₂ → ______ + H₂O
অতএব শূন্যস্থানে হবে ইউরিয়া, (NH₂)₂CO।
২.১৬ দুটি গ্যাসের রাসায়নিক বিক্রিয়ায় কঠিন পদার্থ উৎপন্ন হওয়ার রাসায়নিক সমীকরণটি লেখো।
NH₃(g) + HCl(g) → NH₄Cl(s)
২.১৭ নিচের জৈব যৌগটির IUPAC নাম লেখো।
\begin{array}{c}
\ \ \ H \ \ \ H \ \ \ H \\
\ \ \ | \ \ \ | \ \ \ | \\
H - C - C - C - H \\
\ \ \ | \ \ \ | \ \ \ | \\
\ \ \ H \ \ OH \ \ H
\end{array}
অতএব যৌগটির IUPAC নাম হলো প্রোপান-২-অল (Propan-2-ol)।
অথবা. ইথানোয়িক অ্যাসিডের গঠন সংকেত লেখো।
৩. নিম্নলিখিত প্রশ্নগুলির উত্তর দাও (বিকল্প প্রশ্নগুলি লক্ষণীয়):
৩.১ স্থিতিশীল উন্নয়নের ধারণা কী?
৩.২ ০°C তাপমাত্রায় থাকা নির্দিষ্ট পরিমাণ কোনো একটি গ্যাসকে উত্তপ্ত করা হল। যখন ঐ গ্যাসের চাপ এবং আয়তন উভয়ই আরম্ভকালীন তুলনায় দ্বিগুণ বৃদ্ধি পায়, তখন ঐ গ্যাসের তাপমাত্রা কত?
গ্যাস সমীকরণ অনুযায়ী,
\frac{P_2V_2}{P_1V_1} = \frac{T_2}{T_1}
প্রদত্ত,
P_2 = 2P_1 \quad \text{এবং} \quad V_2 = 2V_1
সুতরাং,
P_2V_2 = (2P_1)(2V_1) = 4P_1V_1
অতএব,
\frac{T_2}{T_1} = 4
⇒ T_2 = 4T_1 = 4 \times 273 = 1092\,K
অতএব, গ্যাসের তাপমাত্রা
1092\,K = (1092 - 273)^\circ C = 819^\circ C
অথবা. 2 g ভরের কোনো গ্যাস 7°C তাপমাত্রায় এবং 2 atm চাপে 820 ml আয়তন অধিকার করে।
গ্যাসটির মোলার ভর নির্ণয় করো।
R = 0.082 \, L\,atm\,mol^{-1}\,K^{-1}
m = 2\,g
T = 7^\circ C = (273 + 7) = 280\,K
P = 2\,atm
V = 820\,ml = 0.820\,L
Ideal gas equation অনুযায়ী,
PV = nRT
অর্থাৎ,
n = \frac{PV}{RT}
এখন, মোলার ভর
M = \frac{m}{n} = \frac{2}{0.0714}
অতএব, গ্যাসটির মোলার ভর = 28\,g\,mol^{-1}
৩.৩ প্রতিসরাঙ্ক 1.5 বিশিষ্ট কাচের ফলকের বা স্ল্যাবের মধ্য দিয়ে একটি আলোকরশ্মির গতিবেগ কত হবে, নির্ণয় করো।
c = 3 \times 10^8 \, ms^{-1}
\mu = 1.5
c = 3 \times 10^8 \, ms^{-1}
সূত্র অনুযায়ী,
\mu = \frac{c}{v}
অতএব,
v = \frac{c}{\mu}
অতএব, কাচের মধ্যে আলোর বেগ = 2 \times 10^8 \, ms^{-1}।
অথবা. একটি উত্তল লেন্স একটি বস্তুর ১০ গুণ বিবর্ধিত প্রতিবিম্ব গঠন করে। যদি বস্তুর দৈর্ঘ্য ৫ cm হয়, তবে প্রতিবিম্বের দৈর্ঘ্য নির্ণয় করো।
বিবর্ধন m = 10
বস্তুর দৈর্ঘ্য h = 5\,cm
সূত্র অনুযায়ী,
m = \frac{h'}{h}
অতএব,
h' = m \times h
অতএব, প্রতিবিম্বের দৈর্ঘ্য = 50\,cm
৩.৪ ৫ Ω রোধ বিশিষ্ট কোনো একটি তারের দৈর্ঘ্য টেনে 20% বৃদ্ধি করা হল। বৃদ্ধির পরে ঐ তারের ঘনত্ব স্থির থাকে এবং তারটির প্রস্থচ্ছেদ সর্বত্র সমান থাকে, তবে ঐ তারটির নতুন রোধ নির্ণয় করো।
প্রাথমিক রোধ R_1 = 5\,\Omega
তারের দৈর্ঘ্য 20% বৃদ্ধি পেয়েছে,
অতএব নতুন দৈর্ঘ্য,
L_2 = 1.2L_1
ঘনত্ব (resistivity) অপরিবর্তিত থাকে এবং তার টানলে আয়তন স্থির থাকে,
অতএব, L_1A_1 = L_2A_2
⇒ A_2 = \frac{L_1}{L_2}A_1 = \frac{1}{1.2}A_1
রোধের সূত্র, R = \rho \frac{L}{A}
অতএব,
R_2 = \rho \frac{L_2}{A_2}
= \rho \frac{1.2L_1}{\frac{1}{1.2}A_1}
= \rho \frac{1.2^2 L_1}{A_1}
অতএব, নতুন রোধ = 7.2\,\Omega
৩.৫ তরল হাইড্রোজেন ক্লোরাইড তড়িৎ পরিবহন সক্ষম নয় কিন্তু গলিত সোডিয়াম ক্লোরাইড তড়িৎ পরিবহন সক্ষম — ব্যাখ্যা করো।
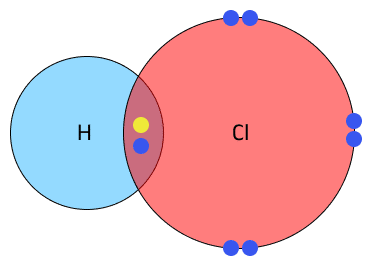
গলিত সোডিয়াম ক্লোরাইড (NaCl): সোডিয়াম ক্লোরাইড একটি তড়িৎযোজী যৌগ। গলিত অবস্থায় এর কেলাসের মধ্যস্থ আয়নিক বন্ধন শিথিল হয়ে যায় এবং Na^+ ও Cl^- আয়নগুলো মুক্তভাবে চলাচলের ক্ষমতা পায়। এই চলনশীল আয়নগুলোই তড়িৎ পরিবহনে সাহায্য করে।অতএব, মুক্ত আয়নের অনুপস্থিতির কারণে তরল HCl তড়িৎ অপরিবাহী কিন্তু মুক্ত আয়নের উপস্থিতির জন্য গলিত NaCl তড়িৎ পরিবাহী।
অথবা. একটি উপযুক্ত আয়নিক যৌগের উদাহরণ দিয়ে বুঝিয়ে দাও যে ঐ আয়নগুলি অষ্টক নীতি মেনে চলে না।
ব্যাখ্যা:১. Li^+ আয়ন: লিথিয়ামের (Li) পরমাণু ক্রমাঙ্ক ৩ এবং ইলেকট্রন বিন্যাস (2, 1)। একটি ইলেকট্রন বর্জন করে এটি Li^+ আয়নে পরিণত হয়, যার ইলেকট্রন বিন্যাস হয় (2)। এটি তার নিকটতম নিষ্ক্রিয় গ্যাস হিলিয়ামের মতো ইলেকট্রন বিন্যাস লাভ করে, অর্থাৎ এটি অষ্টক নীতির পরিবর্তে দ্বৈত নীতি (Duplet Rule) মেনে চলে।
২. H^- আয়ন: হাইড্রোজেনের (H) পরমাণু ক্রমাঙ্ক ১। এটি একটি ইলেকট্রন গ্রহণ করে H^- আয়নে পরিণত হয়, যার ইলেকট্রন বিন্যাস হয় (2)। এটিও হিলিয়ামের মতো স্থিতিশীলতা লাভ করে এবং অষ্টক পূর্ণ করে না। অতএব, LiH যৌগের আয়নসমূহ স্থিতিশীল হলেও তারা অষ্টক নীতি (বাইরের কক্ষে ৮টি ইলেকট্রন) মেনে চলে না।
৩.৬ একটি কঠিন এবং একটি তরল সমযোজী যৌগের উদাহরণ দাও।
তরল সমযোজী যৌগের উদাহরণ — জল (H₂O) বা বেঞ্জিন (C₆H₆)
৩.৭ কিপ যন্ত্রের সাহায্যে প্রস্তুত করা যায় এমন একটি গ্যাসের নাম লেখো। গ্যাসটির প্রস্তুতির বিক্রিয়ার শমিত রাসায়নিক সমীকরণটি লেখো।
H_2S।
প্রস্তুতির শমিত রাসায়নিক সমীকরণ :
সাধারণ তাপমাত্রায় ফেরাস সালফাইড
FeS-এর সঙ্গে লঘু সালফিউরিক অ্যাসিড
H_2SO_4 বিক্রিয়া করলে — FeS + H_2SO_4 \, \text(লঘু) \rightarrow FeSO_4 + H_2S \uparrow
অথবা, লঘু হাইড্রোক্লোরিক অ্যাসিড
HCl ব্যবহার করলে — FeS + 2HCl \, \text(লঘু) \rightarrow FeCl_2 + H_2S \uparrow
শর্ত :
এই পদ্ধতিতে ফেরাস সালফাইডকে ছোট ছোট টুকরো করে কিপ যন্ত্রের মাঝের গোলকে রাখা হয়।
৩.৮ মুক্ত বায়ুতে তামার পাত্র সবুজ বর্ণ ধারণ করে কেন?
এর ফলে তামার ওপর সবুজ বর্ণের ক্ষারীয় কপার কার্বনেট বা বেসিক কপার কার্বনেটের একটি আস্তরণ পড়ে। এই আস্তরণটিকেই তামার মরচে বা ‘প্যাটিনা’ বলা হয়, যার কারণে তামার পাত্র সবুজ দেখায়।
রাসায়নিক সমীকরণ :
2Cu + H_2O + CO_2 + O_2 \rightarrow CuCO_3 \cdot Cu(OH)_2(সবুজ)
এই সবুজ আস্তরণটি তামার ক্ষয় কিছুটা রোধ করলেও এটি বিষাক্ত প্রকৃতির হয়।
অথবা. তামার এবং পিতলের পাত্রে দীর্ঘ সময় ধরে টক খাবার রাখা হয় না কেন? তার দুটি কারণ লেখো।
১. বিষাক্ত লবণের উৎপত্তি :
টক খাবারে বিভিন্ন জৈব অ্যাসিড (যেমন—টারটারিক অ্যাসিড, সাইট্রিক অ্যাসিড) থাকে। এই অ্যাসিডগুলো তামা বা পিতলের সঙ্গে অক্সিজেন ও জলীয় বাষ্পের উপস্থিতিতে বিক্রিয়া করে বিষাক্ত কপার লবণ উৎপন্ন করে। এই ধরনের খাবার গ্রহণ করলে পেটের সমস্যা বা বিষক্রিয়া হতে পারে।
২. পাত্রের ক্ষয় ও স্বাদ পরিবর্তন :
অ্যাসিডের সঙ্গে ক্রমাগত রাসায়নিক বিক্রিয়ার ফলে পাত্রের ভেতরের তলে গর্ত তৈরি হয় এবং পাত্রটি ক্ষয়প্রাপ্ত হয়। এর ফলে খাবারের স্বাভাবিক স্বাদ নষ্ট হয়ে যায় এবং ধাতব স্বাদ তৈরি হয়।
এই কারণেই প্রাচীনকাল থেকে তামা বা পিতলের বাসনের ভেতরের দিকে টিনের প্রলেপ বা ‘কলই’ করার প্রচলন ছিল।
৩.৯ CH_3COOH — একটি জৈব যৌগ কিন্তু NaHCO_3 — জৈব যৌগ নয়। কেন? উভয় ক্ষেত্রে একটি করে কারণ লেখো।
অ্যাসিটিক অ্যাসিডে কার্বন পরমাণুগুলি নিজেদের মধ্যে ক্যাটিনেশন ধর্ম প্রদর্শন করে এবং কার্বন-হাইড্রোজেন C-H সমযোজী বন্ধন গঠন করে। এটি একটি সমযোজী যৌগ এবং জৈব যৌগের বৈশিষ্ট্য বহন করে।
২. NaHCO_3 (সোডিয়াম বাইকার্বনেট) জৈব যৌগ না হওয়ার কারণ :
সোডিয়াম বাইকার্বনেটে কার্বন উপস্থিত থাকলেও এটি কোনো সমযোজী কার্বন শৃঙ্খল গঠন করে না। এটি একটি আয়নীয় লবণ এবং এর ধর্ম অজৈব কার্বনেট লবণের মতো। প্রথাগতভাবে ধাতব কার্বনেট ও বাইকার্বনেটগুলিকে অজৈব যৌগের শ্রেণিতে অন্তর্ভুক্ত করা হয়।
মূল পার্থক্য :
জৈব যৌগে কার্বনের ক্যাটিনেশন ধর্ম ও সমযোজী প্রকৃতি মুখ্য, যা
NaHCO_3-এ অনুপস্থিত।
অথবা. ইথিলিনের গঠন সংকেতের সাহায্যে দেখাও যে এটি একটি অসম্পৃক্ত হাইড্রোকার্বন।
ইথিলিনের গঠন সংকেত :
H_2C = CH_2
ইথিলিন অণুতে দুটি কার্বন পরমাণু নিজেদের মধ্যে একটি দ্বিবন্ধন (Double Bond) দ্বারা যুক্ত থাকে এবং প্রতিটি কার্বন পরমাণু দুটি করে হাইড্রোজেন পরমাণুর সঙ্গে সমযোজী একবন্ধন দ্বারা যুক্ত থাকে।
অসম্পৃক্ততার কারণ :
যেসব হাইড্রোকার্বনে দুটি কার্বন পরমাণুর মধ্যে অন্তত একটি দ্বিবন্ধন C=C বা ত্রিবন্ধন C \equiv C উপস্থিত থাকে, তাদের অসম্পৃক্ত হাইড্রোকার্বন বলে।
যেহেতু ইথিলিনের গঠন সংকেতে কার্বন-কার্বন দ্বিবন্ধন
CH_2=CH_2 বিদ্যমান, তাই এটি একটি অসম্পৃক্ত হাইড্রোকার্বন (অ্যালকিন)।
উপসংহার :
এই দ্বিবন্ধনের উপস্থিতির কারণেই ইথিলিন সহজেই বিভিন্ন যুত বিক্রিয়ায় (Addition Reaction) অংশগ্রহণ করতে পারে।
৪. নিম্নলিখিত প্রশ্নগুলির উত্তর দাও (বিকল্প প্রশ্নগুলি লক্ষণীয়):
৪.১ চার্লসের সূত্রটি লেখো এবং ব্যাখ্যা করো। চার্লসের সূত্র থেকে সেলসিয়াস স্কেলে পরম শূন্যের মান নির্ণয় করো।
স্থির চাপে নির্দিষ্ট ভরের কোনো গ্যাসের তাপমাত্রা 1^\circ C বৃদ্ধি বা হ্রাস করলে, ওই গ্যাসের 0^\circ C তাপমাত্রার আয়তনের যথাক্রমে \frac{1}{273} অংশ বৃদ্ধি বা হ্রাস পায়।
গাণিতিক ব্যাখ্যা :
ধরি, 0^\circ C তাপমাত্রায় নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন V_0। স্থির চাপে তাপমাত্রা t^\circ C বৃদ্ধি করলে গ্যাসের আয়তন V_t হবে —
V_t = V_0 \left( 1 + \frac{t}{273} \right)
যদি তাপমাত্রা হ্রাস করা হয়, তবে সমীকরণটি হবে —
V_t = V_0 \left( 1 - \frac{t}{273} \right)
পরম শূন্য তাপমাত্রার মান নির্ণয় :
চার্লসের সূত্রানুযায়ী,
এখন, যদি t = -273^\circ C হয়, তবে —
V_{-273} = V_0 \left( 1 + \frac{-273}{273} \right)
V_{-273} = V_0 (1 - 1)
V_{-273} = 0
অর্থাৎ, -273^\circ C তাপমাত্রায় চার্লসের সূত্র অনুযায়ী গ্যাসের আয়তন শূন্য হয়ে যায়। এই তাপমাত্রাকেই পরম শূন্য তাপমাত্রা বলা হয়।
উত্তর :
সেলসিয়াস স্কেলে পরম শূন্যের মান
-273^\circ C (সঠিকভাবে -273.15^\circ C)।
৪.২ 216 g HgO কে উত্তপ্ত করে যে পরিমাণ অক্সিজেন পাওয়া যায়, সেই পরিমাণ অক্সিজেন পেতে কত পরিমাণ KClO_3 উত্তপ্ত করতে হবে? Hg = 200,\; K = 39,\; Cl = 35.5,\; O = 16
রাসায়নিক সমীকরণ — 2HgO \rightarrow 2Hg + O_2 \uparrow
আণবিক ভর — 2HgO = 2(200 + 16) = 432\,g
O_2 = 32\,g
ঐকিক নিয়ম অনুযায়ী —
432\,g\,HgO \rightarrow 32\,g\,O_2
216\,g\,HgO \rightarrow \frac{32 \times 216}{432} = 16\,g\,O_2
ধাপ ২ : 16 g O_2 পেতে প্রয়োজনীয় KClO_3 এর পরিমাণ
রাসায়নিক সমীকরণ —
2KClO_3 \xrightarrow{MnO_2 / \Delta} 2KCl + 3O_2 \uparrow
আণবিক ভর —
2KClO_3 = 2(39 + 35.5 + 3 \times 16)
= 2(122.5) = 245\,g
3O_2 = 96\,g
ঐকিক নিয়ম অনুযায়ী —
96\,g\,O_2 \rightarrow 245\,g\,KClO_3
উত্তর :
সমপরিমাণ অক্সিজেন পেতে প্রায় \boxed{40.83\,g\,KClO_3} উত্তপ্ত করতে হবে।
অথবা. কোনো ধাতব কার্বনেটের 200 g উত্তপ্ত করলে 112 g ধাতব অক্সাইড এবং একটি গ্যাসীয় যৌগ উৎপন্ন হয়। গ্যাসীয় যৌগটির বাষ্প ঘনত্ব 22। বিক্রিয়াতে কত মোল গ্যাসীয় যৌগ উৎপন্ন হয়?
ভরের সংরক্ষণ সূত্র অনুযায়ী,
বিক্রিয়কের মোট ভর = উৎপন্ন পদার্থসমূহের মোট ভর।
200 = 112 + \text{উৎপন্ন গ্যাসের ভর}
অতএব, \text{উৎপন্ন গ্যাসের ভর} = 200 - 112 = 88\,g
ধাপ ২ : গ্যাসের মোলার ভর (M) নির্ণয়
আমরা জানি, M = 2 \times D
এখানে বাষ্প ঘনত্ব D = 22
M = 2 \times 22 = 44\,g\,mol^{-1}
(উল্লেখ্য: মোলার ভর 44 হওয়ায় গ্যাসটি হলো CO_2)
ধাপ ৩ : উৎপন্ন গ্যাসের মোল সংখ্যা (n) নির্ণয়
n = \frac{\text{গ্যাসের ভর}}{\text{মোলার ভর}}
n = \frac{88}{44} = 2\,mol
উত্তর :
বিক্রিয়াটিতে উৎপন্ন গ্যাসীয় যৌগের পরিমাণ = \boxed{2\,mol}
৪.৩ লোহার দৈর্ঘ্য প্রসারণের গুণাঙ্ক 12 \times 10^{-6} /^\circ C — ব্যাখ্যা করো। তাপ প্রয়োগে তরলের আয়তন প্রসারণের একটি উদাহরণ দাও।
লোহার দৈর্ঘ্য প্রসারণ গুণাঙ্ক 12 \times 10^{-6} /^\circ C বলে বোঝায় যে, ১ মিটার দীর্ঘ একটি লোহার দণ্ডের তাপমাত্রা 1^\circ C বৃদ্ধি করলে দণ্ডটির দৈর্ঘ্য 12 \times 10^{-6} মিটার বৃদ্ধি পাবে।
অন্যভাবে বলা যায়, তাপমাত্রা 1^\circ C বৃদ্ধি করলে লোহার দণ্ডের প্রাথমিক দৈর্ঘ্যের 12 \times 10^{-6} অংশ বৃদ্ধি ঘটে।
তরলের আয়তন প্রসারণের উদাহরণ :
তাপ প্রয়োগে তরলের আয়তন প্রসারণের একটি পরিচিত উদাহরণ হলো পারদ থার্মোমিটার। যখন থার্মোমিটারকে গরম কোনো বস্তুর সংস্পর্শে আনা হয়, তখন ভেতরে থাকা পারদ তাপ গ্রহণ করে প্রসারিত হয়। যেহেতু কাচের তুলনায় পারদের আয়তন প্রসারণ বেশি, তাই পারদ সরু কৈশিক নলের মধ্য দিয়ে উপরের দিকে উঠে যায় এবং তাপমাত্রা নির্দেশ করে।
অথবা. তরলের আপাত প্রসারণ গুণাঙ্ক এবং তরলের প্রকৃত প্রসারণ গুণাঙ্কের সংজ্ঞা দাও। তাদের মধ্যে সম্পর্কটি লেখো।
তাপমাত্রা 1^\circ C বৃদ্ধি করলে কোনো তরলের প্রকৃত আয়তন যে ভগ্নাংশ বৃদ্ধি পায়, তাকে তরলের প্রকৃত আয়তন প্রসারণ গুণাঙ্ক বলে। এটি পাত্রের প্রসারণ বিবেচনা না করে নির্ণয় করা হয়।
২. তরলের আপাত প্রসারণ গুণাঙ্ক :
তাপমাত্রা 1^\circ C বৃদ্ধি করলে পাত্রের ভেতরে তরলের যে আপাত আয়তন বৃদ্ধি দেখা যায়, তাকে তরলের আপাত আয়তন প্রসারণ গুণাঙ্ক বলে। এক্ষেত্রে পাত্রের আয়তন প্রসারণও প্রভাব ফেলে।
তাদের মধ্যে সম্পর্ক :
\gamma_{real} = \gamma_{apparent} + \gamma_{vessel}
অর্থাৎ,
তরলের প্রকৃত প্রসারণ গুণাঙ্ক = তরলের আপাত প্রসারণ গুণাঙ্ক + পাত্রের আয়তন প্রসারণ গুণাঙ্ক।
৪.৪ উত্তল দর্পণের ক্ষেত্রে বক্রতার ব্যাসার্ধ (r) এবং ফোকাস দৈর্ঘ্য (f) এর মধ্যে সম্পর্কটি প্রতিষ্ঠা করো। উত্তল দর্পণের একটি ব্যবহার লেখো।
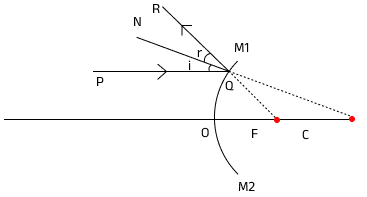
ধরি, M_1OM_2 একটি ক্ষুদ্র উন্মেষযুক্ত উত্তল দর্পণ, যার মেরু O, প্রধান ফোকাস F এবং বক্রতা কেন্দ্র C।
প্রধান অক্ষের সমান্তরাল একটি রশ্মি PQ দর্পণের Q বিন্দুতে আপতিত হয়ে QR পথে প্রতিফলিত হয়। QR রশ্মিকে পিছনের দিকে বর্ধিত করলে তা F বিন্দু থেকে আসছে বলে মনে হয়।
C ও Q যুক্ত করে N পর্যন্ত বর্ধিত করা হলো, যা Q বিন্দুতে অভিলম্ব (CN)।
১. প্রতিফলন সূত্র অনুযায়ী, \angle PQN = \angle RQN
২. যেহেতু PQ \parallel OC, তাই অনুরূপ কোণ, \angle PQN = \angle QCF
৩. আবার, বিপ্রতীপ কোণ, \angle RQN = \angle FQC
৪. সুতরাং, ত্রিভুজ \triangle QFC-এ, \angle QCF = \angle FQC অতএব, FQ = FC
দর্পণের উন্মেষ ক্ষুদ্র হওয়ায় Q বিন্দু O-এর খুব নিকটে। অতএব, FQ \approx FO
সুতরাং, FO = FC
আমরা জানি, OC = OF + FC = OF + OF = 2OF
যেহেতু,
OC = r (বক্রতার ব্যাসার্ধ)
OF = f (ফোকাস দৈর্ঘ্য)
অতএব, r = 2f
অথবা, f = \frac{r}{2} (প্রমাণিত)
উত্তল দর্পণের ব্যবহার :
উত্তল দর্পণ গাড়ির রিয়ার ভিউ মিরর (Rear-view mirror) বা পশ্চাদ্দর্শন আয়না হিসেবে ব্যবহৃত হয়।
কারণ :
এটি সর্বদা বস্তুর সমশীর্ষ ও ক্ষুদ্র প্রতিবিম্ব গঠন করে, ফলে চালক দর্পণে পেছনের বিস্তৃত এলাকা (Wide field of view) দেখতে পান।
অথবা. একই আপতন কোণের জন্য তিনটি ভিন্ন মাধ্যম A, B এবং C এর প্রতিসরণ কোণ যথাক্রমে 30^\circ, 45^\circ এবং 60^\circ। কোন মাধ্যমে আলোর গতি সর্বনিম্ন এবং কেন?
এখানে আপতন কোণ i একই, তাই প্রতিসরণ কোণ r যত কম হবে,
প্রতিসরণাঙ্ক \mu তত বেশি হবে।
প্রদত্ত, r_A = 30^\circ,\quad r_B = 45^\circ,\quad r_C = 60^\circ
অতএব, \sin 30^\circ \lt \sin 45^\circ \lt \sin 60^\circ
সুতরাং, \mu_A \gt \mu_B \gt \mu_C
আবার আমরা জানি,
v = \frac{c}{\mu}
অর্থাৎ, প্রতিসরণাঙ্ক যত বেশি, আলোর বেগ তত কম।
অতএব, A মাধ্যমে আলোর গতি সর্বনিম্ন, কারণ এর প্রতিসরণ কোণ সবচেয়ে কম এবং প্রতিসরণাঙ্ক সবচেয়ে বেশি।
৪.৫ স্বল্প দৃষ্টি বা মায়োপিয়া ঘটার দুটি কারণ লেখো। এর প্রতিকারে কোন ধরনের লেন্স ব্যবহার করা হয়?
এটি চোখের এমন একটি দৃষ্টিত্রুটি যেখানে ব্যক্তি কাছের বস্তু স্পষ্টভাবে দেখতে পেলেও দূরের বস্তু ঝাপসা দেখেন।
মায়োপিয়া ঘটার দুটি প্রধান কারণ :
১. অক্ষিগোলকের অতিবৃদ্ধি :
চোখের অক্ষিগোলকের দৈর্ঘ্য স্বাভাবিকের তুলনায় বেড়ে গেলে লেন্স থেকে রেটিনার দূরত্ব বৃদ্ধি পায়। ফলে দূরের বস্তু থেকে আসা সমান্তরাল আলোকরশ্মি রেটিনায় পৌঁছানোর আগেই রেটিনার সামনে মিলিত হয়ে প্রতিবিম্ব গঠন করে।
২. লেন্সের অভিসারী ক্ষমতা বৃদ্ধি :
চোখের লেন্সের বক্রতা বেড়ে গেলে এর ফোকাস দৈর্ঘ্য f কমে যায়। ফলে দূরের বস্তুর প্রতিবিম্ব রেটিনার আগে গঠিত হয়।
প্রতিকার :
মায়োপিয়া ত্রুটি দূর করার জন্য উপযুক্ত ফোকাস দৈর্ঘ্যের অবতল লেন্স (Concave Lens) ব্যবহার করা হয়।
কার্যপদ্ধতি :
অবতল লেন্স একটি অপসারী লেন্স। এটি দূরের বস্তু থেকে আসা সমান্তরাল আলোকরশ্মিকে অপসারিত (diverge) করে এমনভাবে পাঠায় যেন মনে হয় রশ্মিগুলো চোখের নিকটবিন্দু থেকে আসছে। এই রশ্মিগুলো চোখের লেন্সে পড়ে সঠিকভাবে রেটিনায় ফোকাস হয়, ফলে দূরের বস্তু স্পষ্ট দেখা যায়।
৪.৬ দুটি পরিবাহিকে শ্রেণিবদ্ধভাবে যুক্ত করলে তুল্য রোধ হয় 25 Ω, এবং সমান্তরাল সমবায়ে যুক্ত করলে তুল্য রোধ হয় 6 Ω। প্রতিটি পরিবাহির রোধ নির্ণয় করো।
১. শ্রেণিবদ্ধ সমবায়ের ক্ষেত্রে :
শ্রেণিবদ্ধ সমবায়ে তুল্য রোধ — R_s = R_1 + R_2
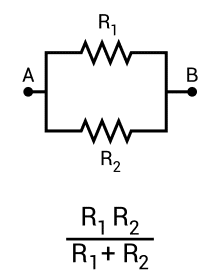
প্রশ্নানুসারে, R_1 + R_2 = 25 \quad ...(i)
২. সমান্তরাল সমবায়ের ক্ষেত্রে :
সমান্তরাল সমবায়ে তুল্য রোধ — R_p = \frac{R_1R_2}{R_1 + R_2}
প্রশ্নানুসারে, \frac{R_1R_2}{R_1 + R_2} = 6
(i) নং সমীকরণ থেকে মান বসিয়ে —
\frac{R_1R_2}{25} = 6
অতএব,
R_1R_2 = 150 \quad ...(ii)
৩. সমাধান :
আমরা জানি,
(R_1 - R_2)^2 = (R_1 + R_2)^2 - 4R_1R_2
অতএব,
(R_1 - R_2)^2 = (25)^2 - 4 \times 150
= 625 - 600 = 25
এখন, (i) ও (iii) নং সমীকরণ যোগ করে পাই —
2R_1 = 30 \Rightarrow R_1 = 15(i) নং সমীকরণে R_1-এর মান বসিয়ে পাই —
15 + R_2 = 25 \Rightarrow R_2 = 10উত্তর :
পরিবাহী দুটির রোধ যথাক্রমে \boxed{15\,\Omega} এবং \boxed{10\,\Omega}।
অথবা. প্রতি B.O.T একক তড়িৎ শক্তির খরচ 5 টাকা। 10টি 50 W বাল্ব প্রতিদিন 10 ঘণ্টা করে ব্যবহার করলে, 30 দিনে এক মাসে তড়িৎশক্তি ব্যবহারের মোট খরচ কত হবে, তা নির্ণয় করো।
আমরা জানি,
\text{ব্যয়িত তড়িৎশক্তি} = \frac{\text{মোট ওয়াট} \times \text{মোট ঘণ্টা} \times \text{দিন}}{1000}
এখানে,
বাল্বের সংখ্যা = 10টি
প্রতিটি বাল্বের ক্ষমতা = 50\,W
প্রতিদিন ব্যবহারের সময় = 10 ঘণ্টা
মোট দিন = 30 দিন
সুতরাং,
= \frac{(10 \times 50) \times 10 \times 30}{1000}
ধাপ ২ : মোট খরচ নির্ণয়
প্রতি B.O.T এককের খরচ = 5 টাকা
উত্তর :
30 দিনে এক মাসে তড়িৎশক্তি ব্যবহারের মোট খরচ = \boxed{750\,টাকা}
৪.৭ সমপ্রবাহ অপেক্ষা পর্যাবৃত্ত প্রবাহ ব্যবহারের যে কোনো দুটি সুবিধা উল্লেখ করো।
জলবিদ্যুৎ উৎপাদন তাপবিদ্যুৎ উৎপাদন অপেক্ষা বেশি পরিবেশ বান্ধব কেন?
১. ভোল্টেজ নিয়ন্ত্রণ :
ট্রান্সফরমারের সাহায্যে খুব সহজে এবং প্রায় বিনা শক্তিক্ষয়ে পর্যাবৃত্ত প্রবাহের বিভব বৃদ্ধি (Step-up) বা হ্রাস (Step-down) করা যায়। সমপ্রবাহ (DC)-এর ক্ষেত্রে এটি জটিল ও ব্যয়সাপেক্ষ।
২. পরিবহনে কম শক্তিক্ষয় :
উচ্চ বিভবে AC প্রেরণ করলে দূরবর্তী স্থানে তড়িৎ পরিবহনের সময় তাপজনিত শক্তিক্ষয় I^2Rt অনেক কমানো যায়। ফলে পাতলা তার ব্যবহার করেও সাশ্রয়ীভাবে বিদ্যুৎ পরিবহন সম্ভব।
জলবিদ্যুৎ উৎপাদন কেন বেশি পরিবেশবান্ধব :
জলবিদ্যুৎ উৎপাদনে নদীর জলের গতিশক্তিকে কাজে লাগিয়ে টারবাইন ঘোরানো হয়। এতে কোনো জীবাশ্ম জ্বালানি (যেমন—কয়লা বা পেট্রোলিয়াম) পোড়াতে হয় না।
ফলে —
• বাতাসে বিষাক্ত গ্যাস যেমন CO_2,\; SO_2,\; NO_2 নির্গত হয় না।
• বায়ুদূষণ ও গ্রিনহাউস প্রভাব বৃদ্ধি পায় না।
অপরদিকে, তাপবিদ্যুৎ কেন্দ্রে কয়লা পোড়ানোর ফলে বায়ুদূষণ ও বিষাক্ত বর্জ্য সৃষ্টি হয়। তাই জলবিদ্যুৎ একটি নবীকরণযোগ্য ও দূষণমুক্ত শক্তির উৎস হিসেবে বেশি পরিবেশবান্ধব।
৪.৮ নিউক্লীয় বিভাজন ব্যাখ্যা করো। নিউক্লীয় বিভাজন নিউক্লীয় সংযোজনের জন্য অপরিহার্য কেন?
যে নিউক্লীয় বিক্রিয়ায় কোনো ভারী পরমাণুর নিউক্লিয়াস (যেমন— {}_{92}U^{235}) ধীরগতিসম্পন্ন নিউট্রনের আঘাতে ভেঙে প্রায় সমান ভরের দুটি হালকা নিউক্লিয়াসে পরিণত হয় এবং সেই সঙ্গে বিপুল পরিমাণ শক্তি ও কয়েকটি নিউট্রন নির্গত হয়, তাকে নিউক্লীয় বিভাজন বলে।
উদাহরণস্বরূপ বিক্রিয়া :
{}_{92}U^{235} + {}_{0}n^{1}\rightarrow{}_{56}Ba^{141} + {}_{36}Kr^{92} + 3\,{}_{0}n^{1}+ বিপুল শক্তি
নিউক্লীয় সংযোজনের জন্য নিউক্লীয় বিভাজনের গুরুত্ব :
নিউক্লীয় সংযোজন (Fusion) বিক্রিয়া ঘটানোর জন্য অত্যন্ত উচ্চ তাপমাত্রা (প্রায়
10^7\,K বা তার বেশি) এবং প্রচণ্ড চাপের প্রয়োজন হয়।
পৃথিবীতে কৃত্রিমভাবে এই বিপুল তাপমাত্রা সৃষ্টি করা সাধারণ দহন বা বৈদ্যুতিক প্রক্রিয়ায় সম্ভব নয়।
নিউক্লীয় বিভাজন বিক্রিয়ার মাধ্যমেই এই প্রচণ্ড তাপ উৎপন্ন করা যায়।
তাই হাইড্রোজেন বোমার মতো সংযোজন-ভিত্তিক যন্ত্রে প্রথমে বিভাজন বিক্রিয়া ঘটানো হয়,
যাতে উৎপন্ন তাপ সংযোজন বিক্রিয়া শুরু করতে পারে।
এই কারণেই নিউক্লীয় বিভাজনকে সংযোজন বিক্রিয়ার ‘সলতে’ বা উদ্দীপক বলা হয়।
৪.৯ মৌলের তড়িৎঋণাত্মকতা বলতে কী বোঝায়? দীর্ঘ পর্যায় সারণিতে গ্রুপ ১ মৌলগুলির তড়িৎঋণাত্মকতা গুচ্ছের উপর থেকে নিচের দিকে কী ধরনে পরিবর্তিত হয়?
কোনো মৌলের পরমাণু যখন অন্য কোনো মৌলের পরমাণুর সঙ্গে সমযোজী বন্ধনে আবদ্ধ থাকে, তখন সেই বন্ধন সৃষ্টিকারী যৌথ ইলেকট্রন জোড়কে নিজের নিউক্লিয়াসের দিকে আকর্ষণ করার ক্ষমতাকে ওই মৌলের তড়িৎঋণাত্মকতা বলা হয়। লিনাস পাউলিং-এর স্কেল অনুযায়ী ফ্লোরিনের তড়িৎঋণাত্মকতা সর্বাধিক 4.0।
গ্রুপ ১ মৌলগুলির ক্ষেত্রে পরিবর্তন :
দীর্ঘ পর্যায় সারণিতে গ্রুপ ১-এর মৌলগুলির (ক্ষার ধাতু) ক্ষেত্রে উপর থেকে নিচের দিকে গেলে —
Li \rightarrow Na \rightarrow K \rightarrow Rb \rightarrow Cs
তড়িৎঋণাত্মকতা ক্রমশ হ্রাস পায়।
হ্রাসের কারণ :
১. পরমাণুর আকার বৃদ্ধি :
গুচ্ছের ওপর থেকে নিচে নামলে প্রতি ধাপে একটি করে নতুন কক্ষপথ যুক্ত হয়, ফলে পরমাণুর ব্যাসার্ধ বৃদ্ধি পায়।
২. আকর্ষণ বলের হ্রাস :
নিউক্লিয়াস থেকে যোজ্যতা কক্ষের দূরত্ব বেড়ে যাওয়ায় যৌথ ইলেকট্রন জোড়ের ওপর নিউক্লিয়াসের স্থির তড়িৎ আকর্ষণ বল দুর্বল হয়ে পড়ে।
৩. আবরণী প্রভাব (Screening effect) :
আভ্যন্তরীণ ইলেকট্রনগুলি নিউক্লিয়াসের আকর্ষণ ক্ষমতাকে বাইরের দিকে বাধা দেয়, ফলে তড়িৎঋণাত্মকতা কমে যায়।
সিদ্ধান্ত :
এই কারণে গ্রুপ ১ মৌলগুলির মধ্যে লিথিয়াম (Li) তুলনামূলক বেশি এবং সিজিয়াম (Cs) অত্যন্ত কম তড়িৎঋণাত্মক মৌল।
অথবা. মোজেলের পরীক্ষার গুরুত্বপূর্ণ সিদ্ধান্তটি কী? পর্যায় সারণির ক্ষেত্রে এই সিদ্ধান্তের গুরুত্ব কী?
১৯১৩ সালে বিজ্ঞানী হেনরি মোজেল বিভিন্ন মৌলের ওপর উচ্চগতিসম্পন্ন ইলেকট্রন আঘাত করে উৎপন্ন X-রশ্মির বর্ণালির ওপর পরীক্ষা চালান। তাঁর প্রধান সিদ্ধান্ত ছিল— মৌলের ধর্মাবলি তার পারমাণবিক ভরের ওপর নয়, বরং পারমাণবিক সংখ্যার ওপর নির্ভরশীল। মোজেল লক্ষ্য করেন যে উৎপন্ন X-রশ্মির কম্পাঙ্কের বর্গমূল \sqrt{\nu} মৌলের পারমাণবিক সংখ্যার Z সাথে সমানুপাতিক। অতএব, পারমাণবিক সংখ্যাই মৌলের প্রকৃত মৌলিক ধর্ম।
পর্যায় সারণির ক্ষেত্রে এই সিদ্ধান্তের গুরুত্ব :
১. আধুনিক পর্যায় সূত্রের ভিত্তি :
মেন্ডেলিভের পর্যায় সূত্র সংশোধিত হয়ে আধুনিক পর্যায় সূত্র প্রতিষ্ঠিত হয়— মৌলসমূহের ধর্ম তাদের পারমাণবিক সংখ্যার পর্যায়বৃত্ত ফাংশন।
২. অসঙ্গতি দূরীকরণ :
মেন্ডেলিভের সারণিতে
Ar ও K,
Co ও Ni
এর অবস্থানগত ত্রুটি পারমাণবিক সংখ্যা অনুযায়ী সাজালে দূর হয়।
৩. আইসোটোপের অবস্থান :
একই মৌলের সকল আইসোটোপের পারমাণবিক সংখ্যা এক হওয়ায় তারা একই ঘরে স্থান পায়।
৪. নতুন মৌল আবিষ্কারে সহায়তা :
পর্যায় সারণিতে কোনো পারমাণবিক সংখ্যা অনুপস্থিত থাকলে সেখানে নতুন মৌল থাকার সম্ভাবনা নির্ধারণ করা যায়।
উপসংহার :
পারমাণবিক সংখ্যাই মৌলের প্রকৃত পরিচয়—এই সিদ্ধান্ত আধুনিক পর্যায় সারণিকে বৈজ্ঞানিক ভিত্তি ও পূর্ণতা প্রদান করেছে।
৪.১০ তড়িৎ বিশ্লেষণের সাহায্যে অ্যালুমিনিয়ামের নিষ্কাশনের জন্য যে গলিত মিশ্রণের তড়িৎ বিশ্লেষণ করা হয়, তাতে বিশুদ্ধ অ্যালুমিনা ছাড়া আর কী কী পদার্থ থাকে? এই তড়িৎ বিশ্লেষণে ক্যাথোড ও অ্যানোড হিসেবে কী ব্যবহৃত হয়?
বিশুদ্ধ অ্যালুমিনা (Al_2O_3)-এর গলনাঙ্ক অত্যন্ত বেশি (প্রায় 2050^\circ C)
তাই গলনাঙ্ক কমানো ও তড়িৎ পরিবাহিতা বাড়ানোর জন্য এর সঙ্গে নিম্নলিখিত পদার্থ মেশানো হয়—
১. ক্রায়োলাইট — Na_3AlF_6
→ এটি গলনাঙ্ক কমিয়ে প্রায় 900^\circ C - 950^\circ C এ নামিয়ে আনে।
২. ফ্লুরস্পার — CaF_2
→ এটি মিশ্রণের তরলতা বজায় রাখে এবং তড়িৎ পরিবাহিতা বৃদ্ধি করে।
ক্যাথোড ও অ্যানোড :
• ক্যাথোড : গ্রাফাইট বা গ্যাস কার্বনের আস্তরণযুক্ত লোহার ট্যাঙ্ক।
• অ্যানোড : গলিত মিশ্রণের মধ্যে ঝুলিয়ে রাখা মোটা গ্রাফাইট দণ্ড।
তড়িৎ বিশ্লেষণ বিক্রিয়া :
ক্যাথোডে — Al^{3+} + 3e^- \rightarrow Al
অ্যানোডে — 2O^{2-} \rightarrow O_2 + 4e^-
উৎপন্ন অক্সিজেন গ্রাফাইটের সঙ্গে বিক্রিয়া করে — C + O_2 \rightarrow CO_2
বিশুদ্ধ অ্যালুমিনা ছাড়াও গলিত মিশ্রণে ক্রায়োলাইট ও ফ্লুরস্পার থাকে।
এই প্রক্রিয়ায় গ্রাফাইট আস্তরণযুক্ত পাত্র ক্যাথোড এবং গ্রাফাইট দণ্ড অ্যানোড হিসেবে ব্যবহৃত হয়।
৪.১১ অ্যামোনিয়াকে বায়ুর অক্সিজেন দ্বারা জারিত ঘটিয়ে কীভাবে নাইট্রিক অক্সাইড উৎপাদন করা হয় তা অনুঘটকের নাম ও বিক্রিয়ার শর্ত উল্লেখসহ লেখো।
বিক্রিয়াটি শমিত রাসায়নিক সমীকরণসহ লেখো।
শুষ্ক ও বিশুদ্ধ অ্যামোনিয়া (NH_3) এবং ধূলিকণামুক্ত বায়ুর মিশ্রণ (আয়তন অনুপাতে ১ : ৯) তীব্র বেগে একটি বিক্রিয়া প্রকোষ্ঠের মধ্য দিয়ে প্রবাহিত করা হয়। সেখানে অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইড উৎপন্ন হয়।
বিক্রিয়ার শর্ত ও অনুঘটক :
• অনুঘটক : প্লাটিনাম-রোডিয়াম (Pt-Rh) সংকর ধাতুর সূক্ষ্ম জালিকা।
• তাপমাত্রা : প্রায় 700^\circ C - 900^\circ C।
• চাপ : প্রায় 5 - 10\,atm।
• সংস্পর্শকাল : প্রায় 0.001\,\text{s} (অত্যন্ত অল্প সময়)।
শমিত রাসায়নিক সমীকরণ :
4NH_3 + 5O_2 \xrightarrow[700^\circ C - 900^\circ C]{Pt-Rh}4NO + 6H_2O + \text{তাপ}ব্যাখ্যা :
এই বিক্রিয়াটি তাপমোচী (Exothermic)। উৎপন্ন তাপ অনুঘটক জালিকাকে লোহিত তপ্ত অবস্থায় রাখতে সাহায্য করে।
উৎপন্ন নাইট্রিক অক্সাইডকে দ্রুত শীতল করা হয়, যাতে এটি পুনরায় বিয়োজিত না হয়।
উত্তর :
প্লাটিনাম-রোডিয়াম জালিকা অনুঘটকের উপস্থিতিতে উচ্চ তাপমাত্রায় অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইড উৎপন্ন হয়।
৪.১২ অ্যাসিটিলিনের সঙ্গে হাইড্রোজেনের যুত বিক্রিয়ার শমিত রাসায়নিক সমীকরণ লেখো এবং বিক্রিয়ার যে কোনো দুটি শর্ত উল্লেখ করো।
অ্যাসিটিলিন (C_2H_2) একটি অসম্পৃক্ত হাইড্রোকার্বন, যাতে কার্বন-কার্বন ত্রিবন্ধন C \equiv C থাকে। অনুঘটকের উপস্থিতিতে এটি হাইড্রোজেনের সঙ্গে যুক্ত হয়ে প্রথমে ইথিলিন এবং পরে ইথেন উৎপন্ন করে।
শমিত রাসায়নিক সমীকরণ :
১. প্রথম ধাপ (ইথিলিন উৎপন্ন) —
HC \equiv CH + H_2 \xrightarrow[150^\circ C - 250^\circ C]{Ni} H_2C = CH_2
২. দ্বিতীয় ধাপ (ইথেন উৎপন্ন) —
H_2C = CH_2 + H_2 \xrightarrow[150^\circ C - 250^\circ C]{Ni} H_3C - CH_3
সম্পূর্ণ বিক্রিয়া —
C_2H_2 + 2H_2 \xrightarrow{Ni} C_2H_6
বিক্রিয়ার দুটি প্রধান শর্ত :
১. সূক্ষ্ম চূর্ণ নিকেল (Ni) অথবা প্লাটিনাম (Pt) / প্যালাডিয়াম (Pd) অনুঘটকের উপস্থিতি।
২. উপযুক্ত তাপমাত্রা (প্রায় 150^\circ C - 250^\circ C)।
এই বিক্রিয়ায় অসম্পৃক্ত অ্যাসিটিলিন হাইড্রোজেন গ্রহণ করে সম্পৃক্ত ইথেন গ্যাসে রূপান্তরিত হয়।
অথবা. অ্যাসিটিক অ্যাসিডের সঙ্গে সোডিয়াম বাইকার্বনেটের বিক্রিয়ার শমিত রাসায়নিক সমীকরণ লেখো। প্যাকেজিং ব্যবহারের জন্য পাট ও পলিথিনের মধ্যে কোনটি পরিবেশবান্ধব এবং কেন?
অ্যাসিটিক অ্যাসিড (CH_3COOH) সোডিয়াম বাইকার্বনেট (NaHCO_3)-এর সঙ্গে বিক্রিয়া করে সোডিয়াম অ্যাসিটেট, জল এবং কার্বন ডাই-অক্সাইড (CO_2) গ্যাস উৎপন্ন করে।
এই বিক্রিয়ায় CO_2 বুদবুদ আকারে নির্গত হয়।
শমিত রাসায়নিক সমীকরণ :
CH_3COOH + NaHCO_3 \rightarrow CH_3COONa + H_2O + CO_2 \uparrow
২. প্যাকেজিংয়ের জন্য পরিবেশবান্ধব উপাদান :
পাট (Jute) পলিথিনের তুলনায় অধিক পরিবেশবান্ধব।
কেন পাট পরিবেশবান্ধব :
১. জৈব-অবক্ষয়যোগ্যতা :
পাট একটি প্রাকৃতিক তন্তু। ব্যবহারের পর এটি অণুজীবের দ্বারা পচে মাটিতে মিশে যায়। পলিথিন জৈব-অবিশ্লেষ্য (Non-biodegradable), যা দীর্ঘ সময় ধরে পরিবেশে থেকে যায়।
২. দূষণ নিয়ন্ত্রণ :
পলিথিন নর্দমা বন্ধ করে এবং পোড়ালে বিষাক্ত গ্যাস নির্গত করে। পাট পরিবেশে তেমন ক্ষতিকর প্রভাব ফেলে না।
৩. পুনর্ব্যবহারযোগ্যতা :
পাট শক্তিশালী ও পুনর্ব্যবহারযোগ্য, সহজে পুনঃপ্রক্রিয়াজাত করা যায়।
পরিবেশ সংরক্ষণ ও সুস্থায়ী উন্নয়নের জন্য পলিথিনের পরিবর্তে পাট ব্যবহার করা অধিক উপযোগী।
আমাদের লক্ষ্য সবসময় শিক্ষার্থীদের জন্য সঠিক ও নির্ভুল তথ্য প্রদান করা। তবুও অনিচ্ছাকৃতভাবে কোনো ভুল হয়ে গেলে, আমরা চাই সেটি যেন দ্রুত সংশোধন করা হয়।
যদি উপরের পোস্টটিতে কোনো ভুল বা অসঙ্গতি খুঁজে পান, অনুগ্রহ করে মন্তব্যে জানাবেন। আপনার সহযোগিতা আমাদের জন্য অমূল্য — কারণ আমরা চাই না কোনো শিক্ষার্থী ভুল শিখুক।
মনে রাখবেন: আপনার দেওয়া ছোট্ট একটি মন্তব্য অনেকের শেখার পথ সঠিক রাখতে সাহায্য করবে।